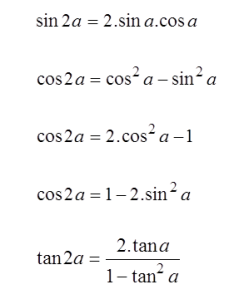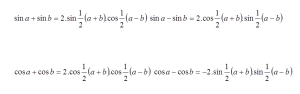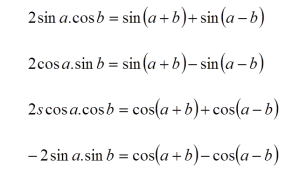Kerangka Tubuh Manusia Tubuh manusia dapat di umpamakan seperti kerangka rumah. Tubuh manusia bagaikan sebuah bangunan yang di topang oleh kerangka. Perumpamaan tersebut dikarenakan susunan kerangka manusia dengan susunan rumah hampir sama dan memiliki bagian - bagian untuk dapat berdiri tegak. Bedanya jika bangunan rumah di topang dengan adanya susunan kerangka kayu yang berguna untuk menopang berdirinya bangunan rumah, manusia di topang dengan adanya kerangka.
Tubuh manusia dapat di umpamakan seperti kerangka rumah. Tubuh manusia bagaikan sebuah bangunan yang di topang oleh kerangka. Perumpamaan tersebut dikarenakan susunan kerangka manusia dengan susunan rumah hampir sama dan memiliki bagian - bagian untuk dapat berdiri tegak. Bedanya jika bangunan rumah di topang dengan adanya susunan kerangka kayu yang berguna untuk menopang berdirinya bangunan rumah, manusia di topang dengan adanya kerangka.
Kerangka tubuh manusia tersusun atas 206 tulang yang saling berhubungan. Hubungan antar tulang disebut sendi. Sendi ada yang dapat digerakkan dan ada juga yang tidak. Sendi yang dapat digerakkan disebut Sendi Gerak. Sedangkan sendi yang tidak dapat digerakkan disebut Sendi Mati.
Tulang - tulang pada manusia membentuk rangka dalam. Berdasarkan zat penyusunnya, tulang dibedakan menjadi tulang keras dan tulang rawan. Berdasarkan bentuknya, tulang dibedakan menjadi tulang pipa, tulang pipih, dan tulang pendek. Berdasarkan letaknya, rangka dapat dibedakan menjadi 3 bagian utama, yaitu rangka kepala (tengkorak), rangka badan, dan rangka anggota gerak.
1. Bagian-Bagian Kerangka Tubuh Manusia
Secara garis besar kerangka tubuh manusia dikelompokkan menjadi tiga kelompok, yaitu rangka kepala (tengkorak), rangka badan, dan rangka anggota gerak.
a. Rangka Kepala (Tengkorak)
Tulang tengkorak berbentuk bulat, sebagian besar tersusun atas tulang-tulang yang pipih. Antara tulang yang satu dengan tulang yang lainnya bersambungan sangat kuat. Fungsi dari tulang kepala (tengkorak) adalah melindungi otak yang merupakan organ tubuh yang sangat penting. Tulang-tulang pada bayi yang baru dilahirkan akan terasa lunak dan belum berkaitan erat dan rapat. Namun seiring berjalannya waktu, tulang-tulang tengkorak mengalami pertumbuhan dan bertambah besar, menyatu dan tidak dapat digerakkan. Tulang tengkorak dapat dibedakan menjadi dua bagian, yaitu tulang bagian kepala dan bagian muka.
1) Tulang Bagian Kepala
Bagian-bagian tulang bagian kepala adalah :
a. Tulang Dahi
b. Tulang Ubun-ubun
c. Tulang Kepala Belakang
d. Tulang Bajie. Tulang Tapis
f. Tulang Pelipis

2). Tulang Bagian Muka
Bagian-bagian tulang bagian muka adalah :
a. Tulang Rahang Atas
b. Tulang Rahang Bawah
c. Tulang Pipi
d. Tulang Langit-langit
e. Tulang Hidung
f. Tulang Air Mata
g. Tulang Lidah
Sebagian besar tulang tulang tengkorak tidak dapat digerakkan. Pada tulang muka, hanya tulang rahang bawah yang dapat digerakkan terhadap tulang rahang atas. Tulang kepala juga berfungsi sebagai pembentuk wajah.
b. Rangka Badan
Rangka badan terdiri dari tulang belakang, tulang dada, tulang rusuk, tulang gelang bahu, serta tulang gelang panggul. Tulang belakang, tulang dada, tulang rusuk membentuk rongga dada yang melindungi paru-paru.

1). Tulang Belakang
Tulang belakang terdiri dari 33 ruas, yaitu:
a. 7 ruas tulang leher
b. 12 ruas tulang punggung
c. 5 ruas tulang pinggang
d. 5 ruas tulang kelangkang (sakrum)
e. 4 ruas tulang ekor
2).Tulang Dada
Tulang dada mempunyai bagian, diantaranya :
a. Hulu
b. Badan
c. Taju Pedang
 3). Tulang Rusuk
3). Tulang Rusuk
Tulang rusuk terdiri atas 12 pasang, yang dapat dikelompokkan sebagai berikut:
a. 7 pasang tulang rusuk sejati. Tulang rusuk ini bagian depan melekat pada badan tulang dada dan bagian belakang melekat pad tulang punggung.
b. 3 pasang tulang rusuk palsu. Tulang rusuk ini nagian depan melekat pada tulang rusuk diatasnya dan bagian belakang melekat pada tulang punggung.
c. 2 pasang tulang rusuk melayang. Tulang rusuk ini bagian belakang melekat pada tulang punggung dan bagian depan tidak melekat pada tulang yang lain.
4). Gelang Bahu
 Tubuh manusia dapat di umpamakan seperti kerangka rumah. Tubuh manusia bagaikan sebuah bangunan yang di topang oleh kerangka. Perumpamaan tersebut dikarenakan susunan kerangka manusia dengan susunan rumah hampir sama dan memiliki bagian - bagian untuk dapat berdiri tegak. Bedanya jika bangunan rumah di topang dengan adanya susunan kerangka kayu yang berguna untuk menopang berdirinya bangunan rumah, manusia di topang dengan adanya kerangka.
Tubuh manusia dapat di umpamakan seperti kerangka rumah. Tubuh manusia bagaikan sebuah bangunan yang di topang oleh kerangka. Perumpamaan tersebut dikarenakan susunan kerangka manusia dengan susunan rumah hampir sama dan memiliki bagian - bagian untuk dapat berdiri tegak. Bedanya jika bangunan rumah di topang dengan adanya susunan kerangka kayu yang berguna untuk menopang berdirinya bangunan rumah, manusia di topang dengan adanya kerangka.Kerangka tubuh manusia tersusun atas 206 tulang yang saling berhubungan. Hubungan antar tulang disebut sendi. Sendi ada yang dapat digerakkan dan ada juga yang tidak. Sendi yang dapat digerakkan disebut Sendi Gerak. Sedangkan sendi yang tidak dapat digerakkan disebut Sendi Mati.
Tulang - tulang pada manusia membentuk rangka dalam. Berdasarkan zat penyusunnya, tulang dibedakan menjadi tulang keras dan tulang rawan. Berdasarkan bentuknya, tulang dibedakan menjadi tulang pipa, tulang pipih, dan tulang pendek. Berdasarkan letaknya, rangka dapat dibedakan menjadi 3 bagian utama, yaitu rangka kepala (tengkorak), rangka badan, dan rangka anggota gerak.
1. Bagian-Bagian Kerangka Tubuh Manusia
Secara garis besar kerangka tubuh manusia dikelompokkan menjadi tiga kelompok, yaitu rangka kepala (tengkorak), rangka badan, dan rangka anggota gerak.
a. Rangka Kepala (Tengkorak)
Tulang tengkorak berbentuk bulat, sebagian besar tersusun atas tulang-tulang yang pipih. Antara tulang yang satu dengan tulang yang lainnya bersambungan sangat kuat. Fungsi dari tulang kepala (tengkorak) adalah melindungi otak yang merupakan organ tubuh yang sangat penting. Tulang-tulang pada bayi yang baru dilahirkan akan terasa lunak dan belum berkaitan erat dan rapat. Namun seiring berjalannya waktu, tulang-tulang tengkorak mengalami pertumbuhan dan bertambah besar, menyatu dan tidak dapat digerakkan. Tulang tengkorak dapat dibedakan menjadi dua bagian, yaitu tulang bagian kepala dan bagian muka.
1) Tulang Bagian Kepala
Bagian-bagian tulang bagian kepala adalah :
a. Tulang Dahi
b. Tulang Ubun-ubun
c. Tulang Kepala Belakang
d. Tulang Bajie. Tulang Tapis
f. Tulang Pelipis

2). Tulang Bagian Muka
Bagian-bagian tulang bagian muka adalah :
a. Tulang Rahang Atas
b. Tulang Rahang Bawah
c. Tulang Pipi
d. Tulang Langit-langit
e. Tulang Hidung
f. Tulang Air Mata
g. Tulang Lidah
Sebagian besar tulang tulang tengkorak tidak dapat digerakkan. Pada tulang muka, hanya tulang rahang bawah yang dapat digerakkan terhadap tulang rahang atas. Tulang kepala juga berfungsi sebagai pembentuk wajah.
b. Rangka Badan
Rangka badan terdiri dari tulang belakang, tulang dada, tulang rusuk, tulang gelang bahu, serta tulang gelang panggul. Tulang belakang, tulang dada, tulang rusuk membentuk rongga dada yang melindungi paru-paru.

1). Tulang Belakang
Tulang belakang terdiri dari 33 ruas, yaitu:
a. 7 ruas tulang leher
b. 12 ruas tulang punggung
c. 5 ruas tulang pinggang
d. 5 ruas tulang kelangkang (sakrum)
e. 4 ruas tulang ekor
2).Tulang Dada
Tulang dada mempunyai bagian, diantaranya :
a. Hulu
b. Badan
c. Taju Pedang
 3). Tulang Rusuk
3). Tulang RusukTulang rusuk terdiri atas 12 pasang, yang dapat dikelompokkan sebagai berikut:
a. 7 pasang tulang rusuk sejati. Tulang rusuk ini bagian depan melekat pada badan tulang dada dan bagian belakang melekat pad tulang punggung.
b. 3 pasang tulang rusuk palsu. Tulang rusuk ini nagian depan melekat pada tulang rusuk diatasnya dan bagian belakang melekat pada tulang punggung.
c. 2 pasang tulang rusuk melayang. Tulang rusuk ini bagian belakang melekat pada tulang punggung dan bagian depan tidak melekat pada tulang yang lain.
4). Gelang Bahu

Gelang bahu terdiri atas 2 buah tulang belikat dan 2 buah tulang selangka.
5). Gelang Panggul
Gelang panggul terdiri atas 2 tulang usus, 2 tulang kemaluan, dan 2 tulang duduk yang bergabung menjadi satu.Gelang panggulberfungsi untuk melindungi alat pencernaan makanan dan alat kelamin.
c. Rangka Anggota Gerak

 Rangka anggota gerak terdiri atas tulang lengan dan tungkai. Tulang lengan terdiri atas tulang lengan atas, tulang hasta, tulang pengumpil, tulang pergelangan tangan, tulang tapak tangan, dan tulang jari tangan.
Rangka anggota gerak terdiri atas tulang lengan dan tungkai. Tulang lengan terdiri atas tulang lengan atas, tulang hasta, tulang pengumpil, tulang pergelangan tangan, tulang tapak tangan, dan tulang jari tangan.
Tungkai terdiri atas tulang paha, tempurung lutut, tulang betis, tulang kering, tulang pergelangan kaki, tulang tapak kaki, dan tulang jari kaki.
B. Hubungan Antar Tulang (Persendian)
Rangka tubuh manusia tersusun oleh tulang-tulang yang saling berhubungan. Hubungan antara tulang yang satu dengan yang lain disebut Sendi. Berdasarkan sifat geraknya, sendi dapat dibedakan atas sendi mati, sendi kaku, dan sendi gerak.
1. Sendi Mati, yaitu hubungan dari beberapa tulang yang tidak mengakibatkan terjadinya gerakan. Contoh : persendian pada tulang tengkorak.
2. Sendi Kaku, yaitu hubungan dari beberapa tulang yang hanya memungkinkan terjadinya sedikit gerakan. Contoh : hubungan tulang rusuk dan tulang dada, ruas-ruas tulang belakang, dan tulang pergelangan tangan.
3. Sendi Gerak, yaitu antara beberapa tulang yang memungkinkan terjadinya gerakan ke satu arah, dua arah, atau segala arah.
Menurut arah gerakannya, sendi gerak dibedakan menjadi sendi engsel, sendi pelana, sendi peluru, dan sendi putar.
a. Sendi Engsel, yaitu persendian yang memungkinkan gerakan ke satu arah. Contoh : persendian pada lutut, persendian pada siku-siku, dan persendian jari tangan.
b. Sendi Pelana, yaitu persendian yang memungkinkan terjadinya gerakan dua arah, seperti orang menunggang kuda diatas pelana. Contoh : persendian antara tulang telapak tangan dengan tulang pergelangan tangan, dan sendi pada ibujari.
c. Sendi Peluru, yaitu persendian yang memungkinkan gerakan ke segala arah. Contoh : persendian antara tulang gelang bahu dengan tulang lengan atas, persendian antara tulang paha dengan tulang panggul.
d. Sendi Putar / Sendi Gulung, yaitu persendian antara beberapa tulang, tempat tulang yang satu bergerak memutar sedangkan tulang yang lain menjadi poros. Contoh : persendian antara tulang tengkorak dengan tulang leher, tulang pengumpil dengan tulang hasta.
C. Fungsi Rangka Tubuh Manusia
Rangka tubuh manusia memiliki beberapa fungsi antara lain sebagai berikut :
1. Untuk menegakkan tubuh, misalnya ruas tulang belakang2. Untuk memberi bentuk tubuh, misalnya tulang-tulang tengkorak memberi bentuk wajah
3. Untuk melindungi alat-alat tubuh yang penting dan lunak, misalnya : kepala
4. Rangka kepala (tengkorak), melindungi otak dan bola mata
5. Ruas tulang leher melindungi tenggorokan dan kerongkongan
6. Rangka dada melindungi alat pernapasan (paru-paru), alat pemompa darah (jantung), dan sebagian alat pencernaan makanan
7. Tulang pinggul melindungi alat pencernaan dan alat reproduksi (kelamin) bagian dalam
8. Tulang belakang melindungi sumsum tulang belakang
9. Sebagai tempat melekatnya otot
10. Sebagai alat gerak pasif
c. Rangka Anggota Gerak

 Rangka anggota gerak terdiri atas tulang lengan dan tungkai. Tulang lengan terdiri atas tulang lengan atas, tulang hasta, tulang pengumpil, tulang pergelangan tangan, tulang tapak tangan, dan tulang jari tangan.
Rangka anggota gerak terdiri atas tulang lengan dan tungkai. Tulang lengan terdiri atas tulang lengan atas, tulang hasta, tulang pengumpil, tulang pergelangan tangan, tulang tapak tangan, dan tulang jari tangan.Tungkai terdiri atas tulang paha, tempurung lutut, tulang betis, tulang kering, tulang pergelangan kaki, tulang tapak kaki, dan tulang jari kaki.
B. Hubungan Antar Tulang (Persendian)
Rangka tubuh manusia tersusun oleh tulang-tulang yang saling berhubungan. Hubungan antara tulang yang satu dengan yang lain disebut Sendi. Berdasarkan sifat geraknya, sendi dapat dibedakan atas sendi mati, sendi kaku, dan sendi gerak.
1. Sendi Mati, yaitu hubungan dari beberapa tulang yang tidak mengakibatkan terjadinya gerakan. Contoh : persendian pada tulang tengkorak.
2. Sendi Kaku, yaitu hubungan dari beberapa tulang yang hanya memungkinkan terjadinya sedikit gerakan. Contoh : hubungan tulang rusuk dan tulang dada, ruas-ruas tulang belakang, dan tulang pergelangan tangan.
3. Sendi Gerak, yaitu antara beberapa tulang yang memungkinkan terjadinya gerakan ke satu arah, dua arah, atau segala arah.
Menurut arah gerakannya, sendi gerak dibedakan menjadi sendi engsel, sendi pelana, sendi peluru, dan sendi putar.
a. Sendi Engsel, yaitu persendian yang memungkinkan gerakan ke satu arah. Contoh : persendian pada lutut, persendian pada siku-siku, dan persendian jari tangan.
b. Sendi Pelana, yaitu persendian yang memungkinkan terjadinya gerakan dua arah, seperti orang menunggang kuda diatas pelana. Contoh : persendian antara tulang telapak tangan dengan tulang pergelangan tangan, dan sendi pada ibujari.
c. Sendi Peluru, yaitu persendian yang memungkinkan gerakan ke segala arah. Contoh : persendian antara tulang gelang bahu dengan tulang lengan atas, persendian antara tulang paha dengan tulang panggul.
d. Sendi Putar / Sendi Gulung, yaitu persendian antara beberapa tulang, tempat tulang yang satu bergerak memutar sedangkan tulang yang lain menjadi poros. Contoh : persendian antara tulang tengkorak dengan tulang leher, tulang pengumpil dengan tulang hasta.
C. Fungsi Rangka Tubuh Manusia
Rangka tubuh manusia memiliki beberapa fungsi antara lain sebagai berikut :
1. Untuk menegakkan tubuh, misalnya ruas tulang belakang2. Untuk memberi bentuk tubuh, misalnya tulang-tulang tengkorak memberi bentuk wajah
3. Untuk melindungi alat-alat tubuh yang penting dan lunak, misalnya : kepala
4. Rangka kepala (tengkorak), melindungi otak dan bola mata
5. Ruas tulang leher melindungi tenggorokan dan kerongkongan
6. Rangka dada melindungi alat pernapasan (paru-paru), alat pemompa darah (jantung), dan sebagian alat pencernaan makanan
7. Tulang pinggul melindungi alat pencernaan dan alat reproduksi (kelamin) bagian dalam
8. Tulang belakang melindungi sumsum tulang belakang
9. Sebagai tempat melekatnya otot
10. Sebagai alat gerak pasif
Rangkuman
Kerangka tubuh manusia tersusun atas 206 tulang yang saling berhubungan. Hubungan antar tulang disebut sendi. Sendi ada yang dapat digerakkan dan ada juga yang tidak. Sendi yang dapat digerakkan disebut Sendi Gerak. Sedangkan sendi yang tidak dapat digerakkan disebut Sendi Mati.
Kerangka tubuh manusia dikelompokkan menjadi tiga kelompok, yaitu rangka kepala (tengkorak), rangka badan, dan rangka anggota gerak. Rangka kepala di bagi menjadi 2 yaitu tlang bagian kepala dan tulang bagian muka. Rangka badan di bagi menjadi 5 yaitu tulang belakang, tulang dada, tulang rusuk, tulang bahu, dan tulang pinggul. Sedangkan rangka anggota gerak di bagi menjadi 2 yaitu tulang gerak atas dan tulang gerak bawah.
Hubungan antara tulang yang satu dengan yang lain disebut Sendi. Berdasarkan sifat geraknya, sendi dapat dibedakan atas sendi mati, sendi kaku, dan sendi gerak. Salah satu fungsi rangka tubuh adalah untuk menegakkan tubuh, misalnya ruas tulang belakang